Confira atividade de soluções, solubilidade e concentração, para compreender e aplicar os conceitos de soluções químicas em contextos práticos, desenvolvendo raciocínio científico e crítico. A atividade foi elaborada para turmas de Química do Ensino Médio. Ao final, confira as habilidades da BNCC que regem essa atividade e o gabarito.
Clique aqui para mais atividades de química.
1) Sobre o conceito de solução química, assinale a alternativa correta:
a) As soluções são misturas homogêneas formadas por um soluto dissolvido em um solvente.
b) Toda solução é uma mistura heterogênea de dois ou mais componentes.
c) Solução é uma mistura em que os componentes podem ser vistos a olho nu.
d) O soluto é sempre líquido, e o solvente sempre sólido.
2) Explique com suas palavras o que diferencia uma solução iônica de uma solução molecular, e dê um exemplo de cada:
3) Observe a curva de solubilidade hipotética abaixo:
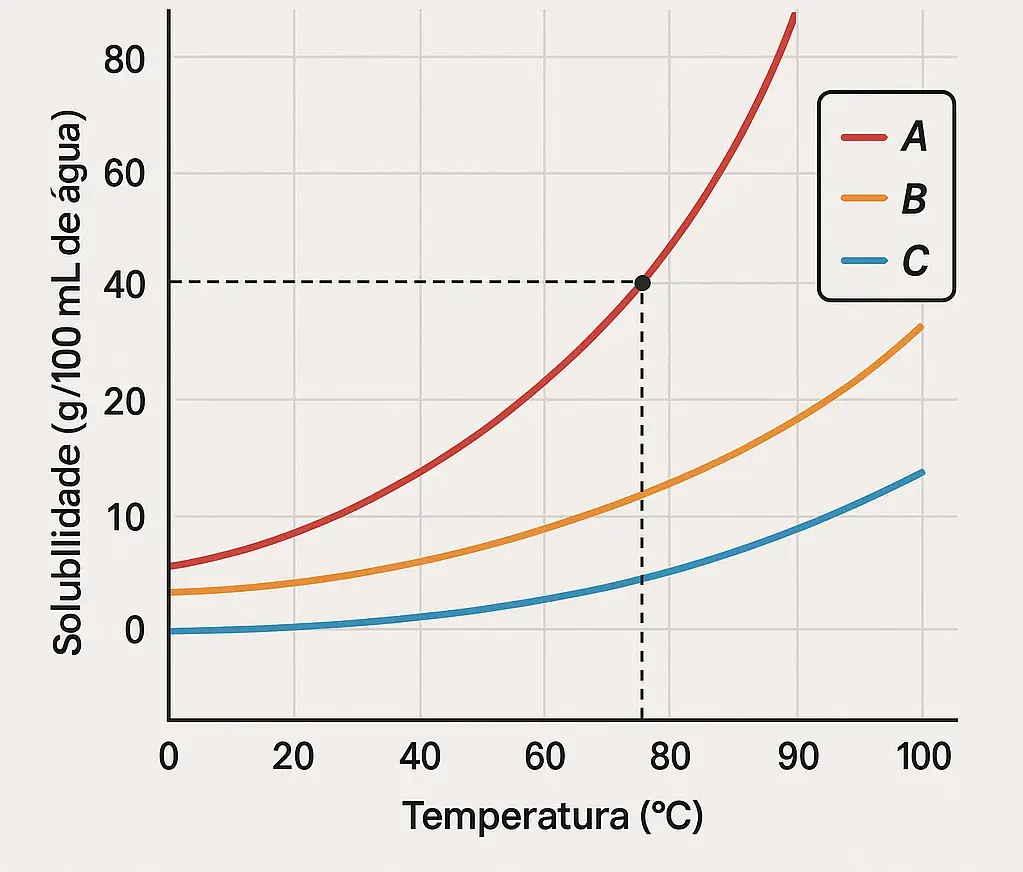
A 75 °C, a substância A apresenta solubilidade de 40 g/100 mL de água. Se dissolvermos 100 g dessa substância na mesma quantidade de água e à mesma temperatura, a solução será:
a) Insaturada
b) Supersaturada
c) Coloidal
d) Saturada
4) Um estudante preparou 250 mL de solução contendo 10 g de NaCl. Sabendo que a massa molar do NaCl é 58,5 g/mol, calcule a concentração em mol/L dessa solução. Mostre os cálculos.
5) Durante uma aula prática, os estudantes analisaram diferentes amostras de soluções formadas por metais fundidos. Uma das misturas observadas foi uma liga metálica composta por cobre e zinco, usada na confecção de instrumentos musicais e peças decorativas.
Com base nessa informação, analise as afirmativas a seguir:
I. Essa liga metálica é um exemplo de solução sólida.
II. As ligas metálicas são formadas por um soluto e um solvente metálicos.
III. As soluções sólidas são sempre compostas por metais.
IV. O bronze e o latão são exemplos de soluções sólidas.
Assinale a alternativa correta:
a) Todas as afirmativas estão corretas.
b) Apenas as afirmativas I e II estão corretas.
c) Apenas as afirmativas I, II e IV estão corretas.
d) Apenas as afirmativas II e III estão corretas.
6) Explique o que são soluções insaturadas, saturadas e supersaturadas. Em que situações do cotidiano essas classificações podem ser observadas?
7) Considere a equação da concentração comum:
C = m/V
Em que C é a concentração em g/L, m é a massa do soluto e V o volume da solução em litros. Calcule a concentração de uma solução preparada com 40 g de glicose dissolida em 200 mL de solução.
a) 0,2 g/L
b) 2 g/L
c) 20 g/L
d) 200 g/L
8) O rótulo de um produto de limpeza informa: "Contém 5% de hipoclorito de sódio (NaClO)". O que essa porcentagem significa no contexto da solução? Como o conceito de concentração está relacionado à eficácia do produto?
9) Em relação aos tipos de soluções, marque a alternativa correta:
a) Soluções coloidais têm partículas visíveis a olho nu.
b) Soluções verdadeiras têm partículas com diâmetro inferior a 1 nm.
c) As dispersões são sempre homogêneas.
d) Emulsões não são consideradas soluções.
10) Explique a diferença entre as três classificações de sistemas dispersos: soluções verdadeiras, coloides e suspensões. Dê um exemplo real para cada tipo.
| Habilidades trabalhadas na atividade de soluções, solubilidade e concentração | Descrição |
| EM13CNT101 | Analisar e representar, com ou sem o uso de dispositivos e de aplicativos digitais específicos, as transformações e conservações em sistemas que envolvam quantidade de matéria, de energia e de movimento para realizar previsões sobre seus comportamentos em situações cotidianas e em processos produtivos que priorizem o desenvolvimento sustentável, o uso consciente dos recursos naturais e a preservação da vida em todas as suas formas. |
| EM13CNT301 | Construir questões, elaborar hipóteses, previsões e estimativas, empregar instrumentos de medição e representar e interpretar modelos explicativos, dados e/ou resultados experimentais para construir, avaliar e justificar conclusões no enfrentamento de situações-problema sob uma perspectiva científica. |
| EM13CNT303 | Interpretar textos de divulgação científica que tratem de temáticas das Ciências da Natureza, disponíveis em diferentes mídias, considerando a apresentação dos dados, tanto na forma de textos como em equações, gráficos e/ou tabelas, a consistência dos argumentos e a coerência das conclusões, visando construir estratégias de seleção de fontes confiáveis de informações. |
Gabarito da atividade de soluções, solubilidade e concentração
Atividade 1: Alternativa A.
Atividade 2: Solução iônica se forma quando solutos iônicos (ex: NaCl) se dissolvem em água liberando íons; já a solução molecular (ex: açúcar) se dissolve sem liberar íons.
Atividade 3: Alternativa D.
Atividade 4: Cálculo: n = 10 / 58,5 = 0,1709 mol → 0,1709 / 0,25 L = 0,684 mol/L
Atividade 5: Alternativa A.
Atividade 6: Insaturada (mais soluto pode ser dissolvido), saturada (quantidade máxima dissolvida), supersaturada (excesso de soluto que precipita); ex: preparo de chá com muito açúcar.
Atividade 7: Alternativa D.
Atividade 8: Espera-se que o aluno interprete como "5 g de NaClO em cada 100 mL de solução" e relacione que maior concentração pode indicar maior poder desinfetante.
Atividade 9: Alternativa B.
Atividade 10: Espera-se: solução verdadeira (ex: sal em água), colóide (ex: leite), suspensão (ex: areia em água).
Este conteúdo te ajudou? Considere colaborar com o nosso site sendo um membro através de uma pequena doação:



